Показана возможность использования метода хромато-масс-спектрометрии для оценки микроэкологического статуса организма человека по масс-спектрометрии микробных маркеров, в качестве которых выступают жирные кислоты, стерины, альдегиды. По анализу жирных кислот методом ХМС можно количественно определять наличие 57 микроорганизмов в ротовой полости человека.
Е.Г. Струкова, А.А. Ефремов*, А.А. Гонтова, Г.А. Осипов, Н.И. Сарматова
Сибирский федеральный университет, Россия 660041, Красноярск, пр. Свободный, 79 1
Применяемые на сегодняшний день в клинической практике методы определения микроэкологического статуса организма человека, а также диагностики инфекций имеют определенные ограничения и недостатки. Например, существенным недостатком классического бактериологического исследования, помимо дороговизны и длительности (7-10 дней), является невозможность оценить роль некультивируемых микроорганизмов, прежде всего анаэробов в инфекционно-воспалительном процессе.
Используемый в качестве дополнительного к классическому иммуно-серологический метод непрямой, поскольку выявляет не возбудителя, а иммунный ответ на него, который может иметь индивидуальные вариации. Известные молекулярно-биологические методы, при несомненных преимуществах — прямое определение возбудителя, высокие специфичность и чувствительность, универсальность, скорость, возможность диагностики хронических и латентных инфекций, – имеют такие серьезные недостатки, как частые ложноположительные результаты и невозможность адекватной количественной оценки [1].
Из всего вышесказанного вытекает очевидная востребованность в надежном количественном экспресс-методе диагностики дисбактериозов и определения возбудителей инфекции. Такими свойствами обладает метод масс-спектрометрии микробных маркеров (МСММ), основанный на количественном определении маркерных веществ микроорганизмов (жирных кислот, альдегидов, спиртов и стеринов) непосредственно в клиническом материале [1-3]. В этом принципиальное отличие метода, придающее ему качественно новое свойство – возможность разложения суперпозиции всего пула микробных маркеров, что позволяет оценить вклад от каждого из сотен видов микроорганизмов, которые обитают, например, в кишечнике. Метод является высокочувствительным, быстрым (2,5 ч на полный цикл исследования), универсальным, экономичным и имеет широкий диагностический спектр. Внедрение ГХ-МС дает возможность сократить время и стоимость исследования, минуя стадии повторных пересевов первичных колоний и тестовых ферментаций, которые особенно сложны, трудоемки и длительны для анаэробов. Метод позволяет не только определять маркерные вещества (жирные кислоты, альдегиды, спирты и стерины) в чистых культурах микроорганизмов, выделенных из клинического материала по известной технологии, но и количественно устанавливать состав микробного сообщества, который кроется за набором маркеров конкретной пробы.
Материалом для исследования служат любые биологические жидкости (кровь, слюна, моча, ликвор и т.д.) [2]. К настоящему времени состав жирных кислот большинства микроорганизмов изучен, показана его воспроизводимость, доказана их родо- и видоспецифичность. Метод детектирования микроорганизмов по ЖКмаркерам сходен с генетическим анализом (ПЦР, определение последовательности нуклеотидов 16sРНК и пр.), поскольку состав жирных кислот детерминирован в ДНК и воспроизводится путем репликации участка генома транспортными РНК и последующего синтеза ЖК в митохондриях по матричным РНК. Другими словами, профиль ЖК так же консервативен, как и строение ДНК. Исследования в области бактериальной палеонтологии подтвердили постоянство состава ЖК отдельных микроорганизмов и пула их жирных кислот, в целом, с глубины времен в 2,5 млрд лет.
В данной работе мы продемонстрируем возможности метода ХМС для оценки микроэкологического статуса и диагностики инфекций организма человека на примере мазка ротовой полости человека. Известно, что бактериям свойственно большое разнообразие ЖК и жирных альдегидов. В настоящее время их насчитывают более двухсот пятидесяти. В организме человека их всего около двадцати пяти. Это обстоятельство определяет возможность родового или видового анализа инфекций и дисбиозов на преобладающем фоне биологической жидкости непосредственно в клиническом материале.
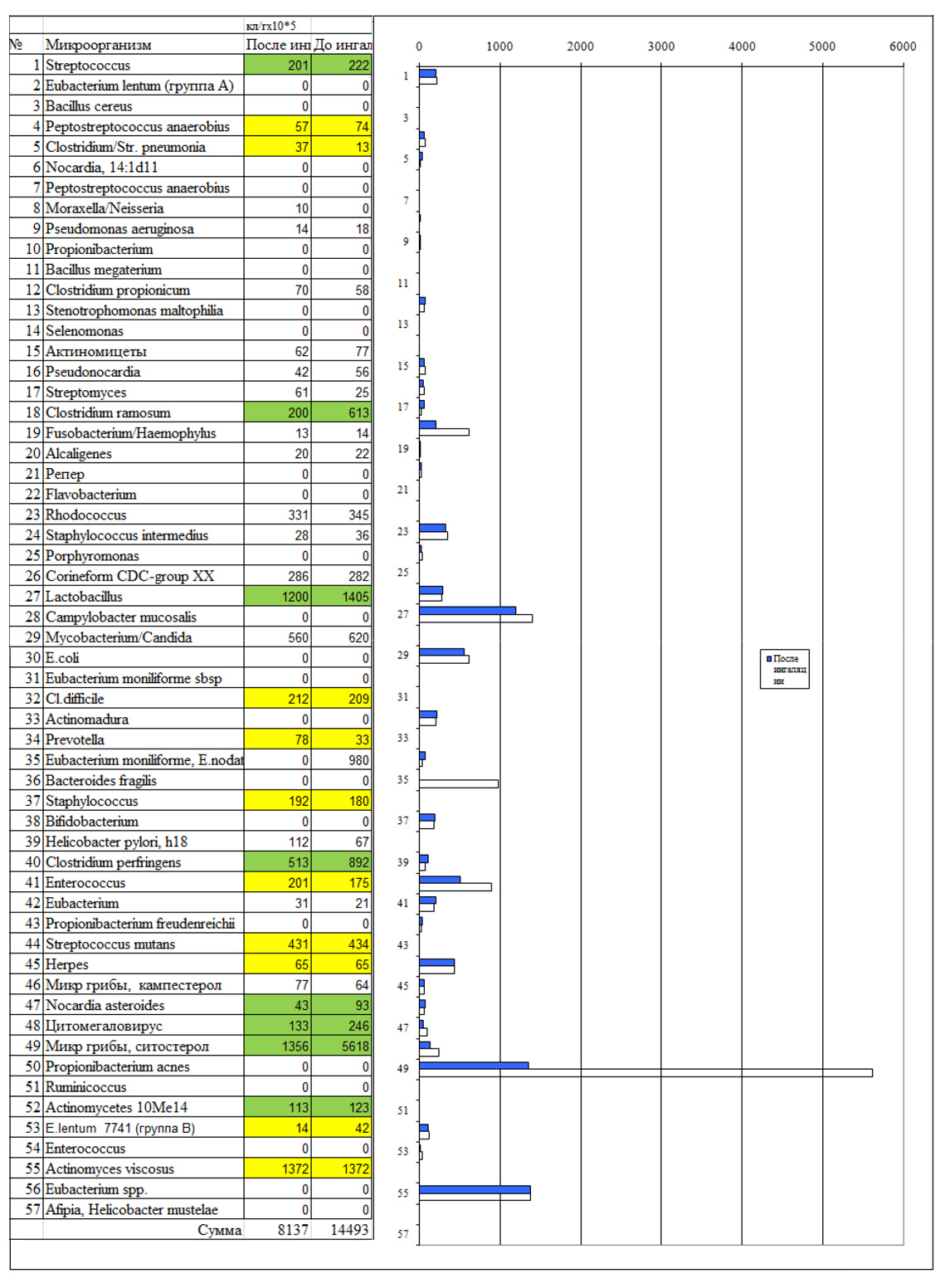
Наиболее часто встречающиеся в клинических пробах ЖК альдегиды и стерины перечислены в табл. 1 с отнесением к вероятным таксонам микроорганизмов [1-2]. Аналогичные зависимости обнаружены для гидроксикислот, спиртов, альдегидов и стеринов [1, 2, 4, 5].
Метод МСММ был применен нами для оценки микроэкологического статуса человека по количественному определению индивидуальных микробных сообществ ротовой полости практически здоровых лиц юношеского возраста обоего пола. Полученные в ходе исследования результаты сравнивались с аналогичными показателями баз данных, включающих сведения о составе жирных кислот штаммов бактерий, вирусов и микроскопических грибов [6, 7].
Материалом для исследования служили мазки со слизистой зева, взятые у 19 клинически здоровых людей в возрасте 18-20 лет. Материал собирали стерильным ватным тампоном, помещали в транспортную угольную среду Эймса и доставляли в лабораторию не позднее 24 ч. При подготовке к хромато-масс-спектрометрическому анализу пробу на ватном тампоне высушивают c добавлением равного по объему количества метанола и подвергают кислому метанолизу в 1М HCl в метаноле. Метанолиз проводят в 0,4 мл реактива на 10 –15 мг сухого остатка в течение 1 ч при 80 °С. На этой стадии происходит освобождение жирных кислот и альдегидов из сложных липидов микроорганизмов и других клеток жидкости в виде метиловых эфиров и диметилацеталей. Эти компоненты экстрагируют гексаном (400 мкл) в течение 5 мин, гексановый экстракт высушивают, а сухой остаток обрабатывают 20 мкл N,О-бис(триметил-силил)- трифторацетамида в течение 15 мин при 80 °С для получения триметилсилильных
эфиров окси-кислот и стеролов. К реакционной смеси эфиров добавляют 80 мкл гексана, и 1-2 мкл раствора вводят в инжектор ГХ-МС системы.
Таблица 1. Высшие жирные кислоты в составе клеточной стенки с отнесением к микроорганизмам, у которых они наиболее часто встречаются*
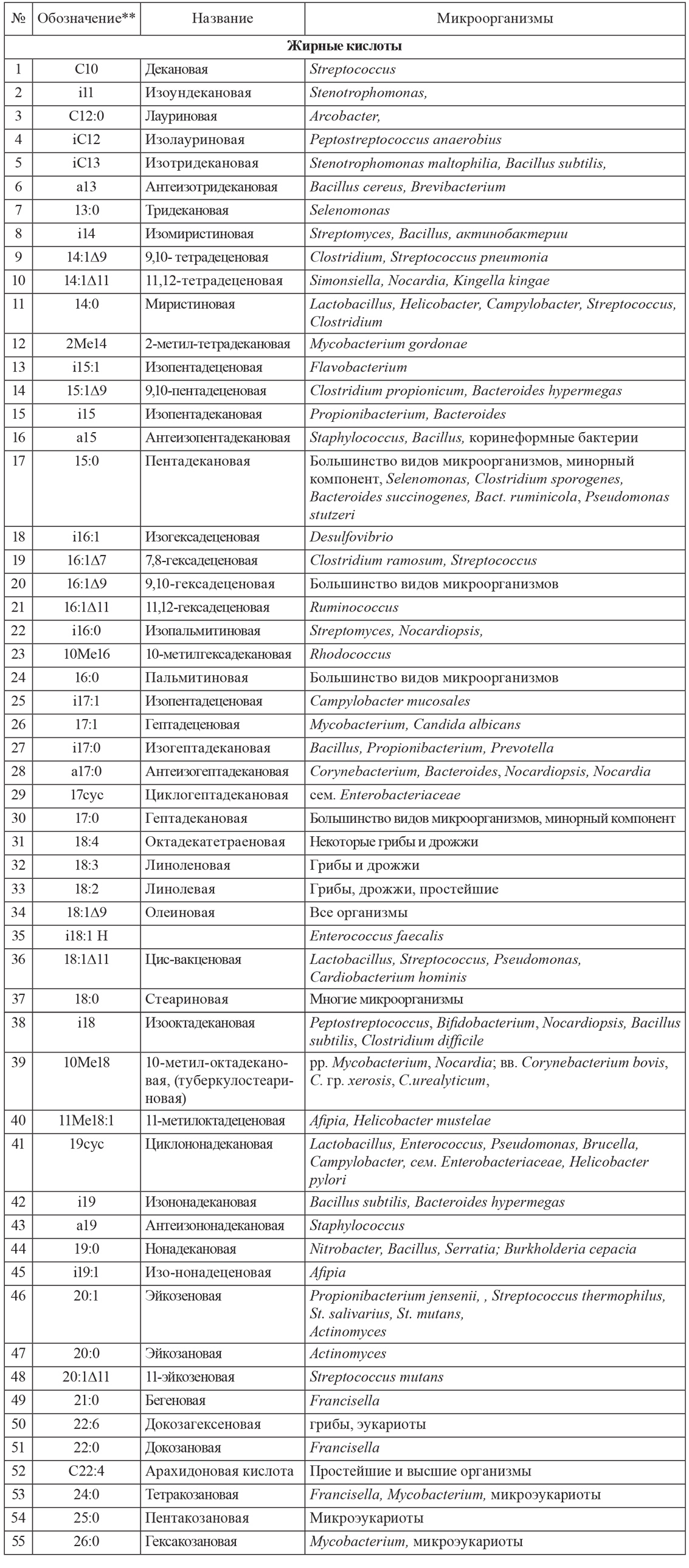
Хроматограмма жирных кислот и других продуктов жизнедеятельности микробных сообществ приведена на рисунке, а ее обработка в пересчете на индивидуальные микробы – в табл. 2.
По результатам проведенной серии анализов установлено, что нормальная микрофлора ротовой полости здоровых молодых людей возраста 18-20 лет, проживающих в Красноярске, выглядит следующим образом: преобладают такие группы микроорганизмов, как Streptococcus, Mycobacterium/Candida, Actinomyces viscosus, микроскопические грибы, ситостерол.
По литературным данным общая обсемененность микробных сообществ должна составлять 6168 кл/г*105 . А по результатам полученных экспериментов практически у 16 пациентов значение общей обсемененности превышает эту величину в 2 раза, варьирует от 6807 до 16233 кл/г*105.
Рис. 1. Типичная хроматограмма жирных кислот мазка ротовой полости здорового человека по выделенным ионам.
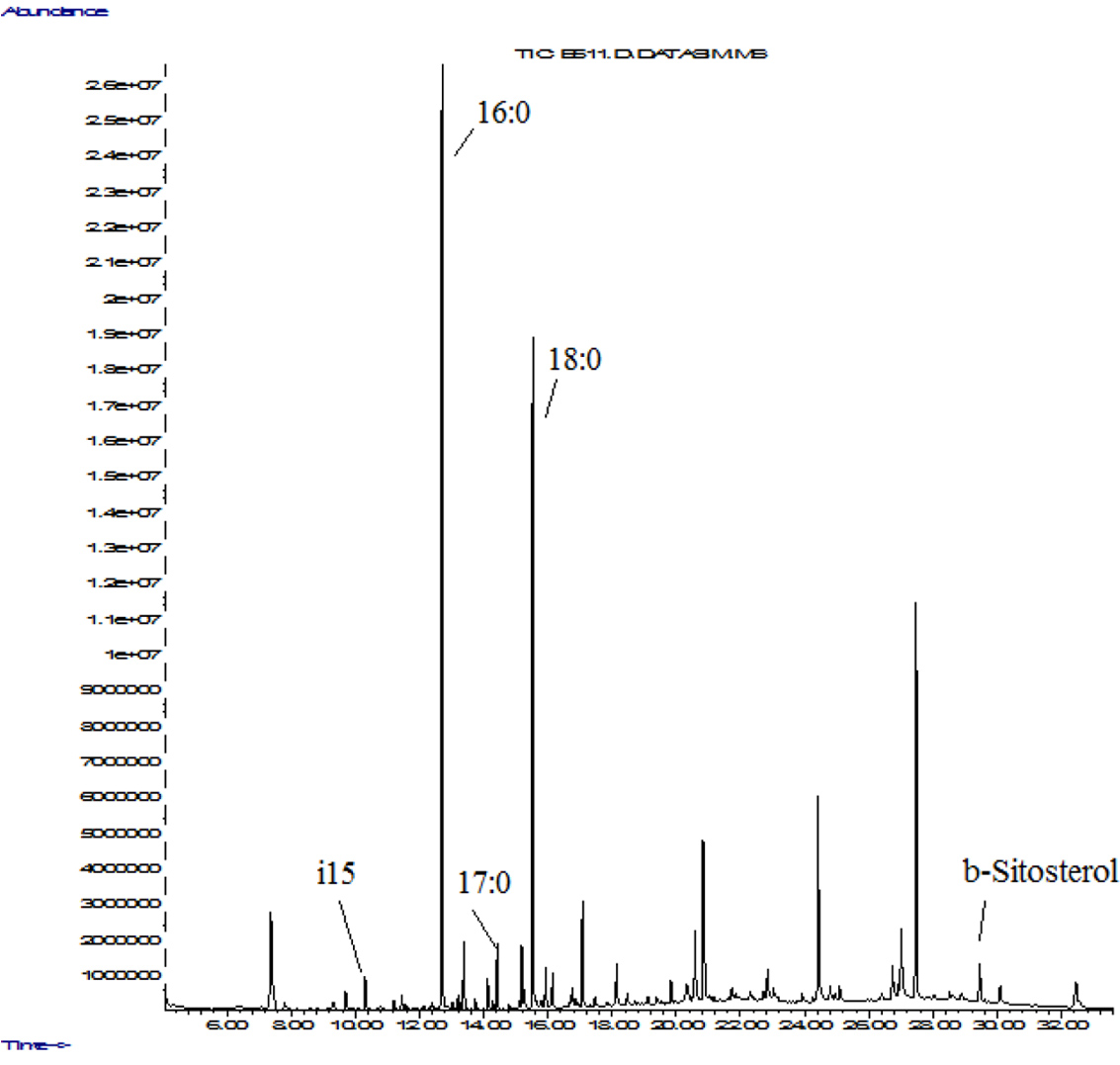
Интересно отметить, что после курса масляных ингаляций 3 %-м пихтовым маслом картина миклофлоры через 2 ч воздействия изменилась, отмечено существенное подавление роста Streptococcus, Clostridium ramosum, Lactobacillus, Clostridium perfringens, Nocardia asteroides, цитомегаловируса, микра грибов, ситостерола, Actinomycetes 10Me14. Неизменным осталось количество Peptostreptococcus anaerobius, Clostridium/Str. Pneumonia, Cl.difficile, Prevotella, Staphylococcus, Enterococcus, Streptococcus mutans, Herpes, E.lentum 7741 (группа В), Actinomyces viscosus. Из полученных результатов можно сделать вывод, что эфирное масло нормализует микрофлору ротовой полости, в отличие от антибиотиков не угнетает общий рост микрофлоры, действует более мягко, не раздражая слизистую [8, 9].
Таблица 2. Результаты исследования микробных маркеров в мазке зева методом хромато-массспектрометрии, проба до и после обработки эфирным маслом.
Проведенная оценка микрофлоры зева здоровых лиц юношеского возраста показала широкий диапазон аэробных и анаэробных микроорганизмов, общее количество которых превышает норму, принятую для здоровых людей средней полосы России.
Следовательно, метод газовой хроматографии – масс-спектрометрии позволяет изучить видовой состав микроорганизмов, населяющих микробиоценозы человека различных биосубстратов. Полученные результаты исследования состава микробных маркеров в мазке зева практически здоровых лиц юношеского возраста дадут возможность использовать эти данные в качестве контрольных значений в дальнейших исследованиях, а также решать вопросы профилактики, выявляя носительство патогенной микрофлоры и формируя группы риска по развитию определенных заболеваний.
Работа выполнена при финансовой поддержке НИР № 1.3.09, проводимой по заданию Федерального агентства по образованию.
Список литературы
1. Минорные жирные кислоты биологических жидкостей урогенитальных органов и их значимость в диагностике воспалительных процессов / Крымцева Т.А., Осипов Г.А., Бойко Н.Б., Соколов Я.А., Демина А.М., Радюшина Т.В., Осипов Д.Г. // Журнал микробиологии эпидемиологии и иммунобиологии. 2003. № 2. С. 92-101.
2. Осипов Г.А., Парфенов А.И., Верховцева Н.В., Ручкина И.Н. и др. Клиническое значение исследования микроорганизмов слизистой оболочки кишечника культурально–биохимическим и хромато–масс–спектрометрическим методами //Эксперим. и клинич. гастроэнтерология. 2003. №4. С.59–62.
3. Митрука Б.М. Применение газовой хроматографии в микробиологии и медицине. М.: Химия, 1980. 256 с.
4. Осипов Г.А. Способ определения родового (видового) состава ассоциации микроорганизмов // Патент РФ № 2086642. С12N 1/00, 1/20, C12Q 1 /4. Приоритет от 24 дек.1993 г.
5. Осипов Г.А., Демина А.М. Хромато-масс-спектрометрическое обнаружение микроорганизмов в анаэробных инфекционных процессах // Вестник РАМН. 1996. Т.13. №2. С. 52-59.
6. Воробьев А.А. Основы микробиологии, вирусологии и иммунологии: учебник. М., 2001. 224с.
7. Koroch A.R., Juliana H.R. Bioactivity of essential oils and their components // Flavours and Fragrances. 2005.
8. Стецюк О.У. Зависимость фармокодинамических параметров антибиотиков от условий определения чувствительности бактериальных возбудителей внебольничных и госпитальных инфекций: дисс. … канд. биол. наук. Смоленск, 2000.
9. Хуснутдинова Л.М. Микрофлора слизистой оболочки миндалин человека в норме при патологии // Журнал микробиологии эпидемиологии и иммунобиологии. 2006. №1. С.60-63. Е.Г. Струкова, А.А. Ефремов,.. Определение микроэкологического статуса и диагностика инфекций.

