Состояние кишечника влияет на различные системы в организме человека. Существует гипотеза о Leaky gut syndrome («синдром дырявой кишки»), состояние, которое по мнению некоторых врачей-практиков, является причиной широкого спектра хронических состояний, включая синдром хронической усталости, аллергические состояния, заболевания кожи, ряд аутоиммунных заболеваний, ожирение, сахарный диабет 2 типа, болезней связанных с нарушением оси мозг-кишечник – депрессии, тревожность и другиеэмоциональные расстройства, нейродегенеративные болезни.
Несмотря на то, что официальной наукой не признается понятие Leaky gut syndrome, не вызывает сомнение, что повышенная проницаемость кишечника может быть вызвана спектром внешних факторов – микробная и грибковая контаминация, алкоголь, некоторые лекарственные препараты, ксенобиотики внешней среды; и также может быть патогенетическим фактором развития ряда заболеваний кишечника и вне кишечных заболеваний.
Защитный барьер кишечника: непрерывный слой цилиндрического эпителия с тесным соприкосновением клеток друг с другом, покрывающий эпителий гликокаликс, ферменты мембранного пищеварения, а также связанную с поверхностью эпителия мембранную флору (М-флору). Последняя посредством гликоконъюгированных рецепторов соединяется с поверхностными структурами эпителия, усиливая выработку слизи и уплотняя цитоскелет эпителиоцитов.
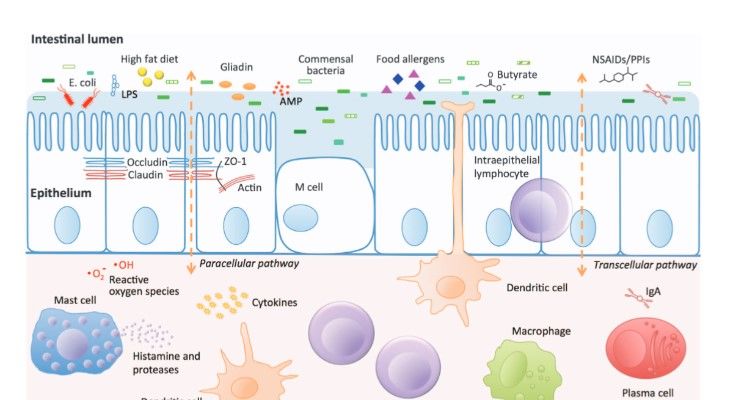
Суть эпителиального защитного барьера — граница между внутренней частью кишечника и остальным организмом, его состояние играет ключевую роль в гомеостазе.
Гипотеза leaky gut syndrome подразумевает, что кишечные микробные продуценты вызывают системное низкоуровневое воспаление на уровне эпителиального защитного барьера, что является триггером развития ряда заболеваний. Микробная транслокация, связанная с дисфункцией кишечной оболочки и гиперпроницаемостью, доказана при целом ряде патологических состояний.
Микробная транслокация – это проникновение микроорганизмов , а также их продуцентов, из просвета желудочно-кишечного тракта через слизистый барьер в крово- или лимфоток. В определенных количествах микробная транслокация присутствует всегда. Проникающие в подслизистый слой бактерии захватываются макрофагами и транспортируются в брыжеечные лимфоузлы. При проникновении в кровоток они захватываются и уничтожаются купферовскими клетками печени. Нарушение баланса поступления и элиминации происходит при сочетании как минимум трех факторов: увеличение проницаемости слизистой, неконтролируемый рост микрофлоры кишечника и изменение ее нормального состава (дисбиоз), нарушение местного иммунитета кишечника.
Среди патогенных микробных продуцентов наиболее широко изучен эндотоксин. Обзор основных результатов исследований в различных клинических ситуациях, указывает, что уровень эндотоксина в плазме очевидно является одним из маркеров микробной транслокации.
Эндотоксин — это фактор патогенности грамотрицательной бактерии, содержащийся в ее стенке.
Клеточная стенка бактерий, как грамотрицательных, так и грамположительных имеет плазматическую мембрану и слой пептидогликана . Слой пептидогликана состоит из углеводной и пептидной цепи и добавляет структурную прочность клеточной стенке. Грамотрицательные бактерии отличаются тем, что их пептидогликановый слой намного тоньше, чем у грамположительных бактерий, но за то, у них есть внешняя оболочка, покрывающая его.
Эта наружная мембрана содержит слой липополисахарида (LPS). В пределах липидной части этого слоя находится липид А, который является опасным эндотоксином. Антибиотики, проникая в эту наружную мембрану, делают грамотрицательные бактерии устойчивыми.
Грамотрицательные бактерии выделяют опасные эндотоксины прежде всего, когда их убивают. Это может произойти, когда иммунная система или антибиотики атакуют бактерии и разрушают их клеточные стенки. Когда стенки клеток разрушаются, фрагменты наружной мембраны высвобождаются, включая эндотоксины. Чрезмерная выработка эндоксинов стимулирует развитие местной воспалительной реакции, с повреждением эндотелия кишки и нарушением кишечного барьера.
Эндотоксин пересекает нарушенный кишечный барьер пара целлюлярно ( между клетками) или может поглощаться энтероцитами, повреждая липопротеины их мембран. Его обнаружение в крови имеет важную диагностическую значимость в отношении гипотезы leaky gut при различных заболеваниях.
Существуют также другие маркеры микробного проникновения в кровь, такие как пептидогликаны микробной стенки, флагеллин, определяющий антигенную специфичность бактерии, липотейхоевая кислота, содержащаяся в клеточной стенке бактерий, (1 → 3) -β-D-глюкан – содержащийся в клетках дрожжевой инфекции.
В качестве передатчиков информации о микробах и повреждении тканей в организме человека работают Toll-подобные рецепторы (TLR).
Toll-подобные рецепторы — это семейство молекул, распознающих консервативные патоген-ассоциированные паттерны микробных структур (PAMP – Pathogen- associated Molecular pattern), то есть проще говоря различающие молекулы патогенных микробов. В этом качестве они абсолютно необходимы для определения стратегий защиты организма-хозяина от микробных патогенов. Кроме того, Toll-подобные рецепторы играют важную роль в поддержании тканевого гомеостаза , например при заживлении поврежденных тканей. Судя по всему, TLR делают это путем распознавания микробов и эндогенных сигналов апоптоза (клеточной смерти) и повреждения тканей.
Анализ Toll-подобных рецепторов указывает, что несколько микробных продуцентов действуют одновременно как патоген-ассоциированные молекулярные структуры (PAMPs), иными словами – молекулы патогенных бактерий, при прогрессировании различных заболеваний.
Микробные продуценты попадают из просвета кишечника в кровоток через нарушенные межклеточные соединения. Они реагируют на toll-подобные рецепторы (TLR) в макрофагах, лимфоцитах и других клетках и индуцируют воспаление в различных тканях. Каждый TLR обнаруживает свою специфическую патоген-ассоциированную молекулярную структуру (PAMP), что отражено на схеме ниже.
Уровни PAMPs – молекул патогенных микробов в крови увеличиваются в различных клинических ситуациях. Эндотоксин является самым значимым циркулирующим маркером, отражающим микробную транслокацию в кишечнике. Его обнаружение методологически определено методом ГХМС ( по Осипову Г.А.)
Другие микробные продуценты находятся в стадии изучения и пока не могут рассматриваться, как универсальные медиаторы воспаления в крови. Хотя их взаимосвязь с кишечной проницаемостью и про воспалительными цитокинами и хемокинами, очевидна.
На рисунке представлена схема:
Кишечная дисфункция, основные микробные транслокационные маркеры в крови и последующие воспалительные изменения в органах-мишенях.
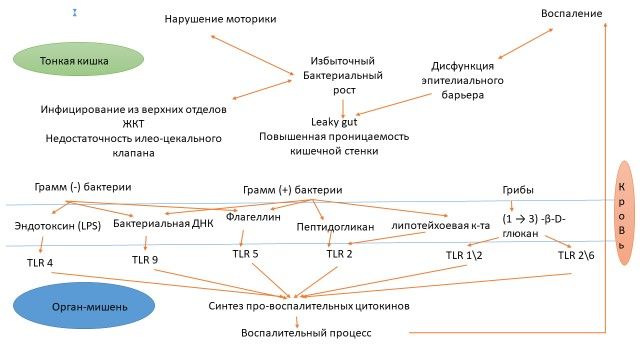
LPS: липополисахарид, TLR: Toll-подобный рецептор.
Нарушения в тонком кишечнике – нарушения моторики, инфицирование и чрезмерный бактериальный рост, дисбиоз и дисфункция эпителиальных барьеров тесно связаны друг с другом и впоследствии приводят к разнообразной микробной транслокации. Транспонированные микробные продуценты грамотрицательных и грамположительных бактерий и грибов в крови одновременно действуют на Toll-подобные рецепторы различных клеток, что провоцирует иммунный ответ, синтез про-воспалительных цитокинов, вызывающий воспалительные процессы в органах-мишенях.
В таблице (Hiroshi Fukui ) представлены уровни циркулирующих маркеров микробной транслокации в отношении экспрессии TLR (Toll-подобных рецепторов) в различных клинических ситуациях.
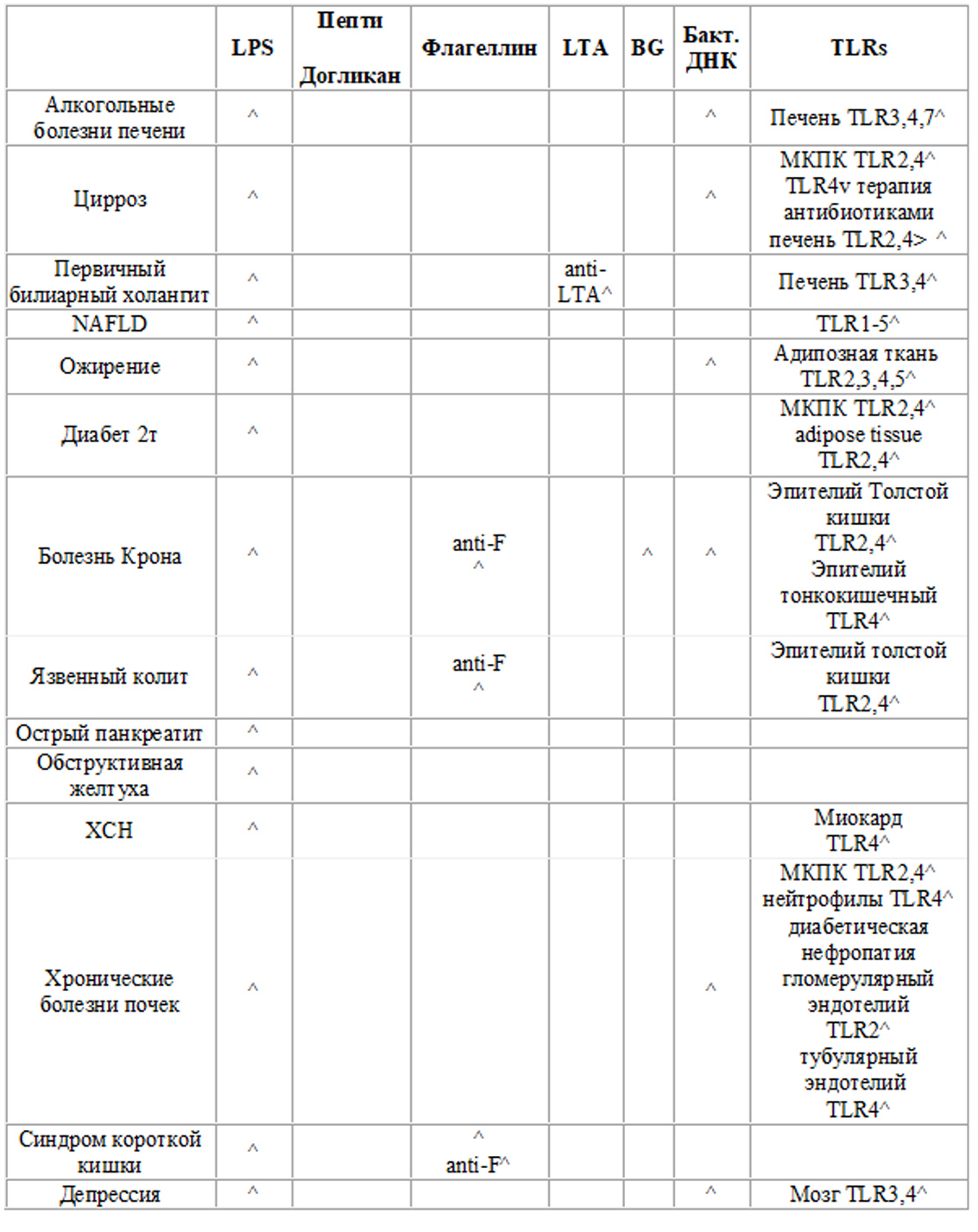
LPS: липополисахарид (эндотоксин), LTA: липотейхоевая кислота, BG : (1→3)-β-D-глюкан. ↑: увеличение, ↓: уменьшение
Определение эндотоксина в плазме рассматривается как микробный транслокационный маркер, возможно имеющий раннее прогностическое значение в клинической практике. .
Исследования патогенеза leaky gut syndrome и последствий воздействия циркулирующих микробных продуцентов, дают представление о триггерных механизмах развития хронических заболеваний и помогают в выборе терапевтической стратегии.
Рациональная модуляция микробиома и проницаемости кишечника является краеугольным камнем для профилактики целого ряда хронических заболеваний.