По материалам диссертации П.С. Адеишвили (канд. мед. наук) РГМУ г.Москва и статьи в журнале «Детские инфекции», №2 2012, в печати. Использованы также данные к.м.н. врача ЛОР И.Андриановой по аденоидитам (Красноярский федеральный университет) и амбулаторные данные Академической группы Аккад РАМН Ю.Ф.Исакова (НЦ ССХ им А.Н.Бакулева, Москва).
Введение
В силу ряда причин исследование микробиоты зева классическими бактериологическими методами в условиях клинической бактериологичой лаборатории сильно затруднено или полностью невозможно. Реализация задачи требует подключения специализированных лабораторий с арсеналом культуральных и некультуральных методов, позволяющих обеспечить количественный анализ полимикробной инфекции одного больного. Как правило, это требует значительных материальных и временных затрат, не совместимых со стоимостью и временем пребывания больного в стационаре. Еще более важна несовместимость с темпом развития воспалительного процесса. Возникает необходимость внедрения новых экспресс-методов диагностики инфекционного статуса пациента.
Таким методом можно считать метод масс-спектрометрии микробных маркеров (МСММ), позволяющий в ускоренном режиме, минуя стадию культивирования и тестовых ферментаций, определить спектр доминирующих микроорганизмов (более 104 клеток в пробе) по молекулярным маркерам – клеточным высшим жирным кислотам, альдегидам и стеринам [Осипов, 2010].
Суть анализа состоит в прямом извлечении с помощью химической процедуры высших жирных кислот из подлежащего исследованию образца, их разделении на газовом хроматографе в капиллярной колонке высокого разрешения и анализа состава в динамическом режиме на масс-спектрометре. Хроматограф соединен в едином приборе с масс-спектрометром и снабжен компьютером с соответствующими программами автоматического анализа и обработки данных, сам процесс анализа занимает 30 мин, а с учетом времени пробоподготовки и расчета данных — не более 2,5 часов.
Внедрение МСММ позволяет сократить время и стоимость исследования, минуя стадии повторных пересевов первичных колоний и тестовых ферментаций, которые особенно сложны, трудоемки и длительны для анаэробов. В этом методе применен математический аппарат количественного реконструирования состава микроорганизмов в очаге воспаления по составу их маркеров в биопробе, что позволяет контролировать инфекцию в динамике заболевания, а также эффективность лечения. В период разгара заболевания всем пациентам проводили забор пробы с миндалин бактериологическими тампонами, которые хранили в замороженном состоянии (при -5 оС). Для ГХ-МС анализа вату с тампона переносили в реакцинный сосуд (виал) и подвергали кислому метанолизу в 0,4 мл 1 М HCl в метаноле в течение 45 мин при 80 °С. Полученные в результате реакции метанолиза микробных липидов жирные кислоты в виде метиловых эфиров двукратно экстрагировали 200 мкл гексана, высушивали и обрабатывали в 20 мкл N,О-бис(триметилсилил)-трифторацетамида в течение 15 мин при 80 °С для получения триметилсилильных эфиров гидрокси-кислот и стеролов. В реакционный сосуд добавляли 40 мкл гексана и 2 мкл смеси вводили в инжектор ГХ-МС системы 5850/5973 Agilent Technologies (США). Для управления и обработки данных использовали штатные программы прибора. Хроматографическое разделение пробы осуществляли на капиллярной колонке с метилсиликоновой привитой фазой HP –5MS Agilent.
Анализ и обоснование принадлежности маркеров конкретным микроорганизмам осуществляли по технологии «Оценка микроэкологического статуса человека методом хромато-масс-спектрометрии» (разрешение Росздравнадзора ФС 2010/038 от 24.02.2010). Таким способом определяют эффективную (то есть соответствующую измеренной в данный момент концентрации маркера) численность микроорганизмов разных таксонов, в том числе анаэробов, актинобактерий, дрожжей, грибов и вирусов – всего 170 таксонов, введенных в программу скриннига маркеров. В число определяемых по маркерам микроорганизмов входят не только те, что находятся в момент отбора пробы на поверхности очага воспаления, но и находящиеся внутри слоя ткани, из которого химические вещества отмирающих микроорганизмов могут поступать с экссудатом.
Начиная с 60-х годов ХХ века считалось, что поражение ротоглотки при ИМ имеет вирусно-бактериальное происхождение, причем роль микробной инфекции является определяющей, что определяло назначение антибактериальной терапии при ИМ. Однако частое использование антибиотиков при лечении ангин привело к возросшему числу сыпей у детей, в том числе к токсикоаллергическим.
Нерациональное употребление антибиотиков, назначаемых по данным культурального теста на чувствительность, приводит к увеличению антибиотикорезистентных микробных штаммов, а также губительно действует на нормальную микробиоту организма. С другой стороны, одностороннее назначение антибиотиков, нацеленных на культивируемые микроорганизмы, дает приоритет некультивируемым в условиях клинических бактериологических лабораторий микроорганизмам – анаэробам, аэробным актинобактериям, грибам и вирусам. Более того, многочисленные данные показывают, что колонизация слизистых оболочек является полимикробной в норме [Wilson, 2008] а любая инфекция является полиэтиологичной [Бутов, 2011; Osipov, 2011]. В том числе и при ангине [Brook, 1997; 1999; Chole, 2003]. В этой ситуации тактика антибиотикотерапии должна учитывать качественную и количественную приоритетность отдельных видов в совокупном инфекционном сообществе. Для реализации такого подхода необходимо применение некультуральных молекулярных методов, которые получили развитие в конце прошлого века.
2. Результаты исследования
Используя метод масс-спектрометрии микробных маркеров оказалось возможным установить по мазкам из зева наличие микроорганизмов, принадлежащих к 51 таксону (таблица 1). По результатам анализа микробного сообщества пациентов (n=25) по сравнению со здоровыми донорами (n=10) обнаружено систематическое клинически значимое (более чем вдвое по сравнению с нормой [Beloborodova, 2000]) увеличение численности бактерий 21 таксона, а именно видов Moraxella, Fusobacterium, Streptococcus (оральные и анаэробные S. mutans), Prevotella, Propionibacterium (P. acnes, P. jensenii, P. freudenreichii), Eubacterium/Clostridium, актинобактерий Streptomyces, Actinomyces Bacteroides fragilis, Peptostreptococcus anaerobius, вирусов герпеса и других микроорганизмов. Это означает, что у детей с ИМ имеет место полимикробная инфекция ротоглотки, что проявляется клинически значимым увеличением численности бактерий (на два порядка и более) 27 видов аэробов, анаэробов, актинобактерий грибов и вирусов из исследуемых 56 таксонов , по сравнению с детьми без поражения ротоглотки, а также обнаружено участие нормофлоры в возникновении ангины. Данный факт патогенетически обосновывает назначение лекарственных средств для восстановления мукозального иммунитета и нормализации микробиоты. В том числе дает информацию для этиотропной антибиотикотерапии.
Таблица 1. Усредненный состав и количество микроорганизмов в мазке у детей с ИМ в разные периоды заболевания (n=22)
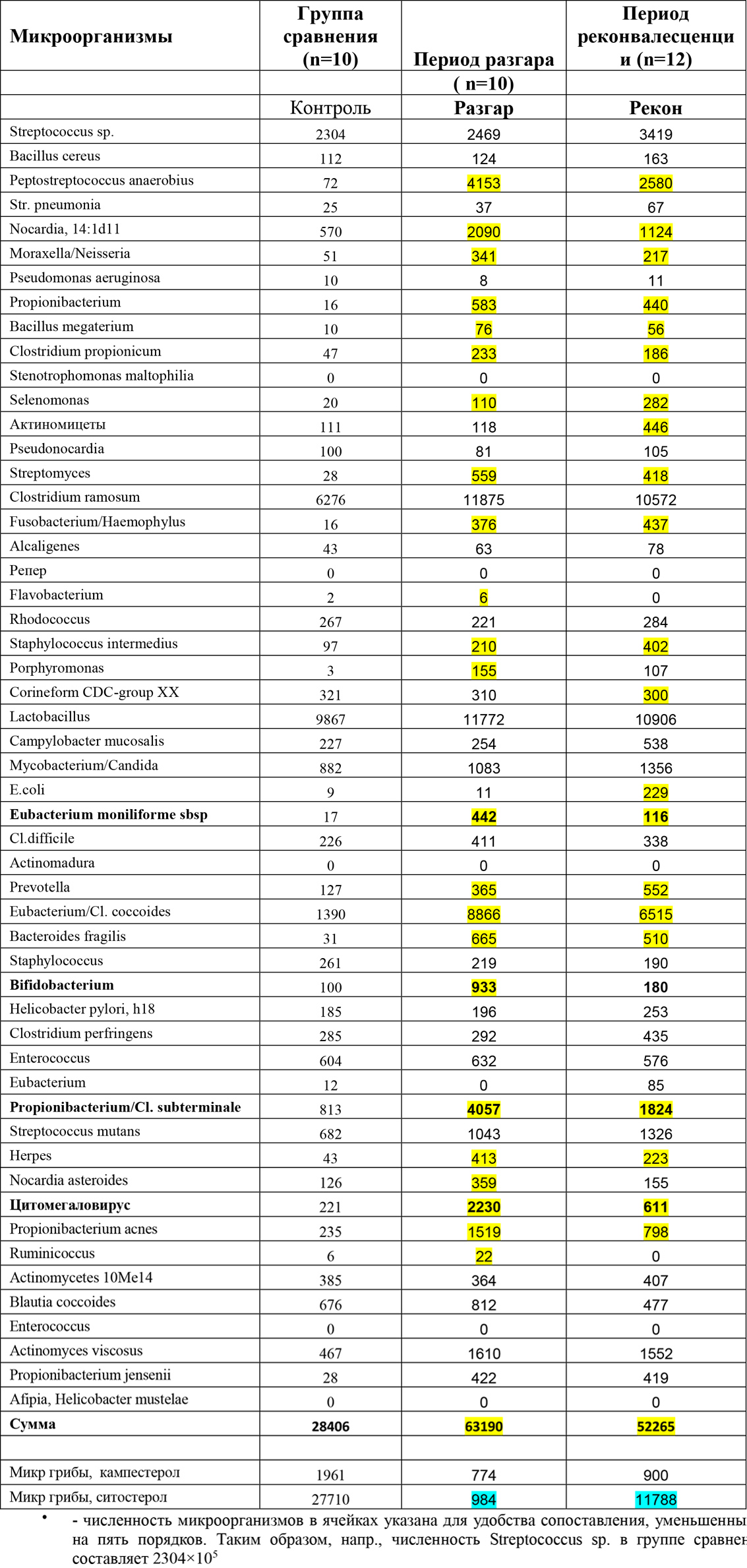
Рис 1. Диаграммы, построенные по данным таблицы 1 графически в динамике подверждают активное участие Peptostreptococcus anaerobius, Bacteroides fragilis, видов Moraxella/Neisseria, Eubacterium/Cl. coccoides и Bifidobacteriumв инфекционном процессе от минимума в норме, достигая максимума в разгаре и снижаясь в период реконвалесценции.
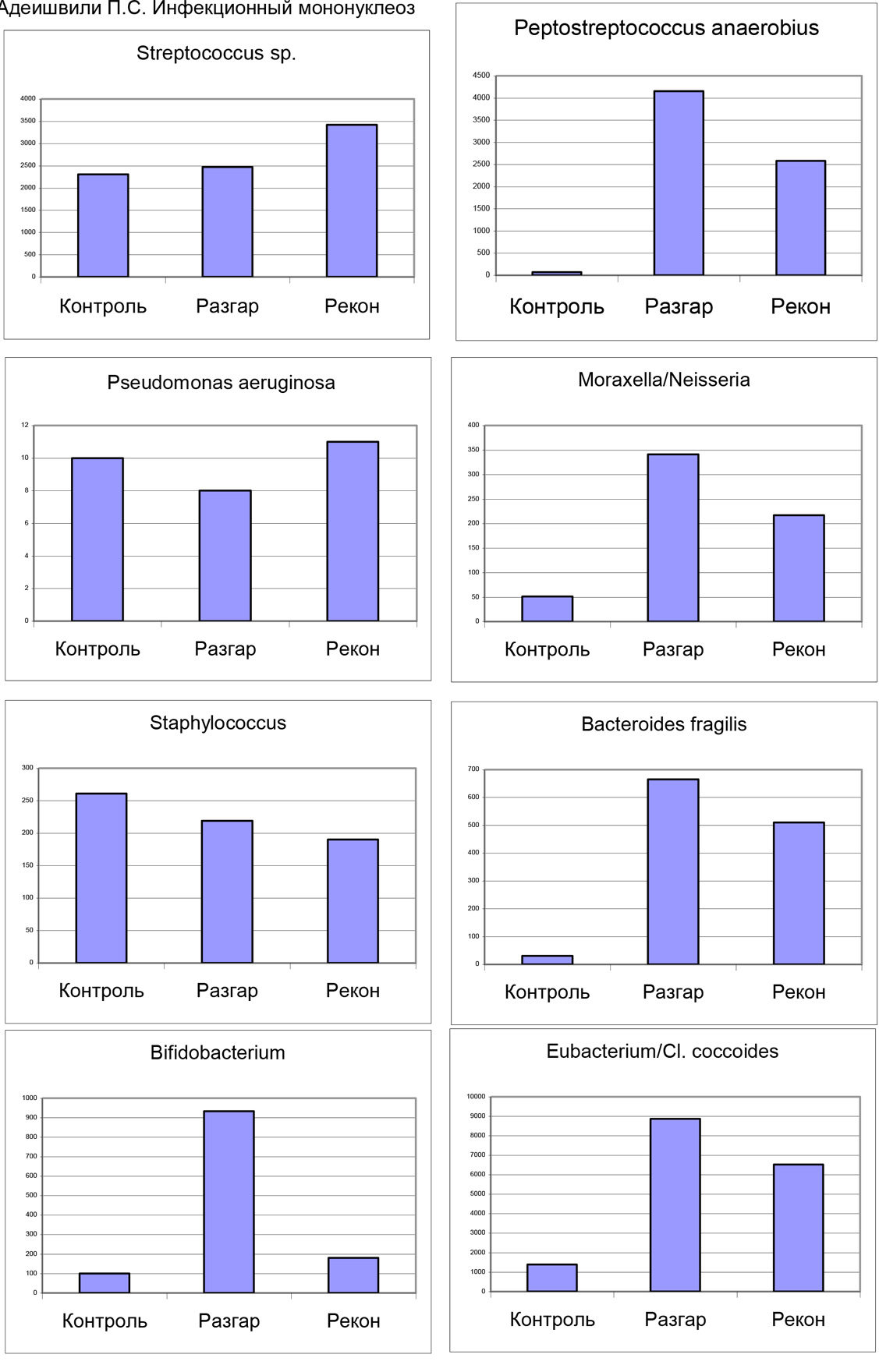
Концентрация маркеров другой группы микроорганизмов не превышает в среднем уровень колонизации слизистой зева у доноров. К ним относятся представители родов Staphylococcus, Lactobacillus, Streptococcus, коринебактерии, Pseudonocardia, Stenothrophomonas и другие. Микроскопические грибы (не кандида) — плесневые, дерматофиты и другие оказываются в дефиците у пациентов.
Следует отметить, что концентрация маркеров части микроорганизмов в слизистой зева доноров больше чем в среднем в крови здоровых людей, что означает повышенную колонизацию зева этими микробами в норме. К ним относятся клостридии группы C. ramosum, Helicobacter, C. perfringens, Prevotella, Bacteroides fragilis и микроскопические грибы (не кандида).
У некоторых доноров можно усмотреть начало инфекции – там, где превышение нормы наблюдается только в отдельных случаях. Ранняя диагностика? Однако здесь не уместны усреднения. Каждый пациент индивидуален в проявлении инфекции. Поэтому, в ряде случаев за счет усреднения сглаживается участие отдельных представителей – например, стрептококков и псевдомонад. Как видно из гистограмм, приведенных ниже, их активность многократно возрастает у отдельных детей и должна индивидуально учитываться при лечении.
Наибольшая кратность увеличения концентрации маркеров микроорганизмов в мазке отмечена для фузобактерий, бактероидов, стрептомицетов, анаэробного пептострептококка – на два порядка и более по сравнению с нормой. До 30 раз увеличивается численность моракселл и пропионобактерий, на порядок возрастает численность бактерий группы Eubacterium/Clostridium, а также стрептококков, нокардий, превотел, актиномицетов.
Метод МСММ дает возможность определить концентрацию липополисахарида (ЛПС) – эндотоксина грамотрицательных бактерий пересчетом суммы гидрокси-кислот из состава его липида-А, по которым детектируются конкретные батерии этого типа – псевдомонады, моракселлы, бактероиды и другие. Его концентрация составляет 0,1 – 3 наномоля в тампоне и превышают норму до 30 раз у пациентов по сравнению с группой доноров.
Начиная с 60-шестидесятых годов ХХ века превалировало мнение о вируснобактериальном происхождении ангины при ИМ, причем роль микробной флоры являлась определяющей. Данный факт обосновывал назначение антибактериальной терапии при ИМ. Некоторые авторы указывали на ведущую роль вируса в формировании патологических изменений в зеве и роль патогенных микроорганизмов в возникновении ангины считали минимальным. Однако сегодня ряд авторов говорят о бактериальном генезе наложений при ИМ, но при этом подчеркивают, что антибактериальная терапия неэффективна. Неэффективность антибиотиков объясняется, с одной стороны, отсутствием чувствительности основного возбудителя к терапии, с другой — присутствием грибковой флоры в ротоглотке.
Применение метода масс-спектрометрии микробных маркеров объясняет этот кажущийся парадокс. Ведь антибиотики выбирали исходя из данных посева на питательные среды, которые определяли стрептококки, стафилококки и непатогенные нейссерии. Количественные данные метода МСММ показывают, что эти микробы действительно присутствуют в клиническом материале (табл 1), но их количество в основной и контрольной группах одинаково. Это означает, что это нормальная составляющая микробиоты и бороться с ней не надо – только вредить организму, что и подтверждают полученные экспериментальные данные. На самом деле истинными инфекционными агентами являются те, которые обнаруживают наибольшую кратность увеличения численности у больных по сравнению с контролем. Как показано выше (табл 1), наибольшая кратность увеличения концентрации маркеров микроорганизмов отмечена у анаэробного пептострептококка и Porphyromonas spp (в 40 раз), фузобактерий (в 24 раза), Bacteroides fragilis (17 раз) , стрептомицетов (20 раз). До 30 раз увеличивалась численность моракселл и пропионобактерий, на порядок возрастала численность бактерий группы Eubacterium/Clostridium, а также нокардий, превотел и актиномицетов. Из этого следует, что эффект антибиотикотерапии будет положительным, если она будет адекватной истинным возбудителям.
Учитывая данные МСММ, полученные в этой работе, можно предположить, что доминанты инфекции – пептострептококк, клостридии, эубактерии, другие анаэробы, а также актинобактерии оказались невосприимчивыми к назначенным препаратам.
Напротив, угнетение минорной составляющей инфекции — cтафилококки, стрептококки, непатогенные нейссерии – стимулировало конкурентное развитие некультивируемой, основной группы микробных агентов.
Рис. 2. Реконструкция полимикробной инфекции мо методу МСММ в мазке девочки, у которой максимально инфицировано лимфоидно-глоточное кольцо. В колонке «проба» расчетная численность микроорганизмов в клетках на грамм мазка с умножением на 10 в 5 степени.
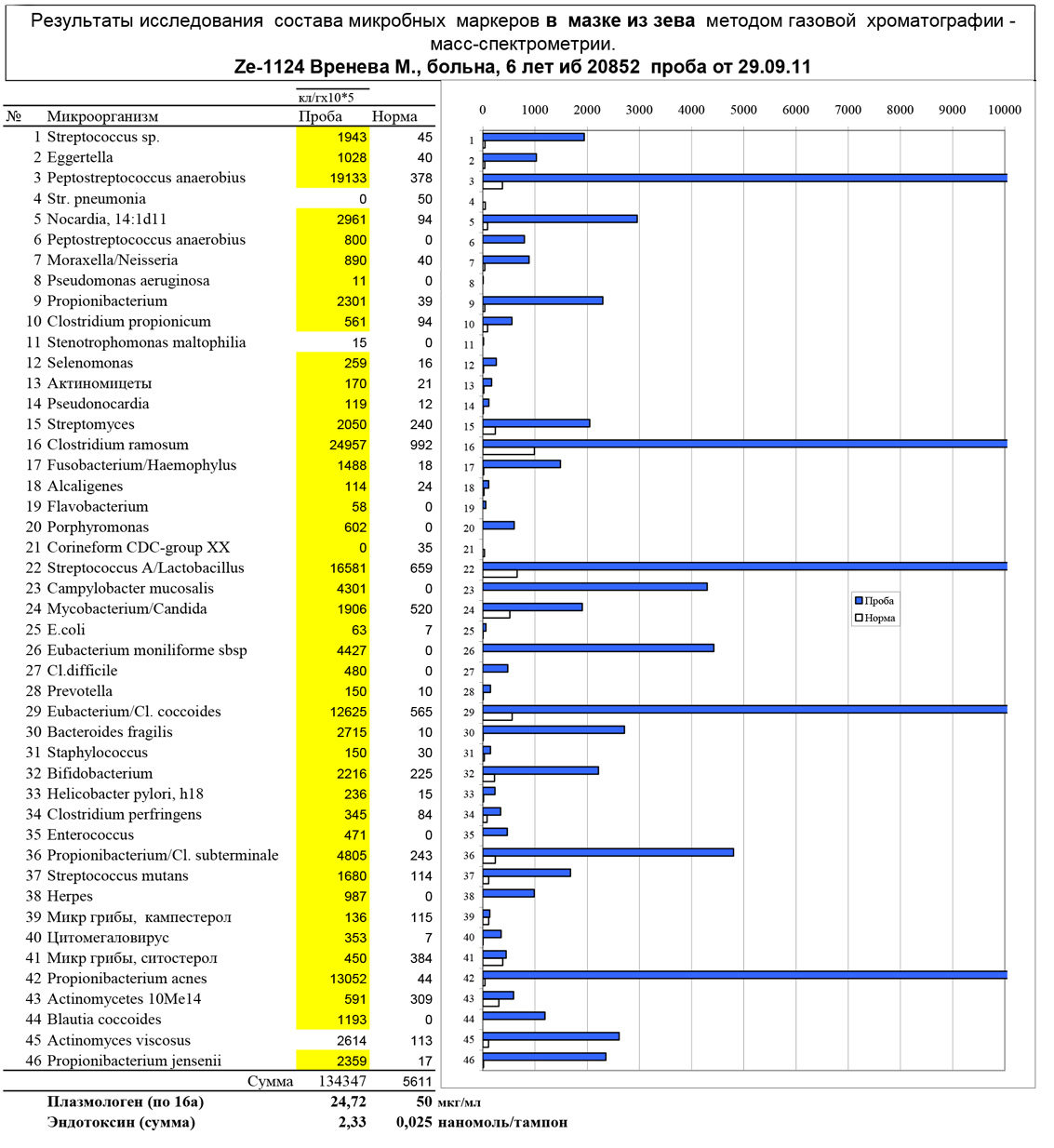
Рис. 3. Реконструкция полимикробной инфекции мо методу МСММ в мазке с миндалин ребенка с хроническим аденоидитом. В колонке «проба» расчетная численность микроорганизмов в клетках на грамм мазка с умножением на 10 в 5 степени. Данные врача ЛОР И.Андриановой (не опубликованы).
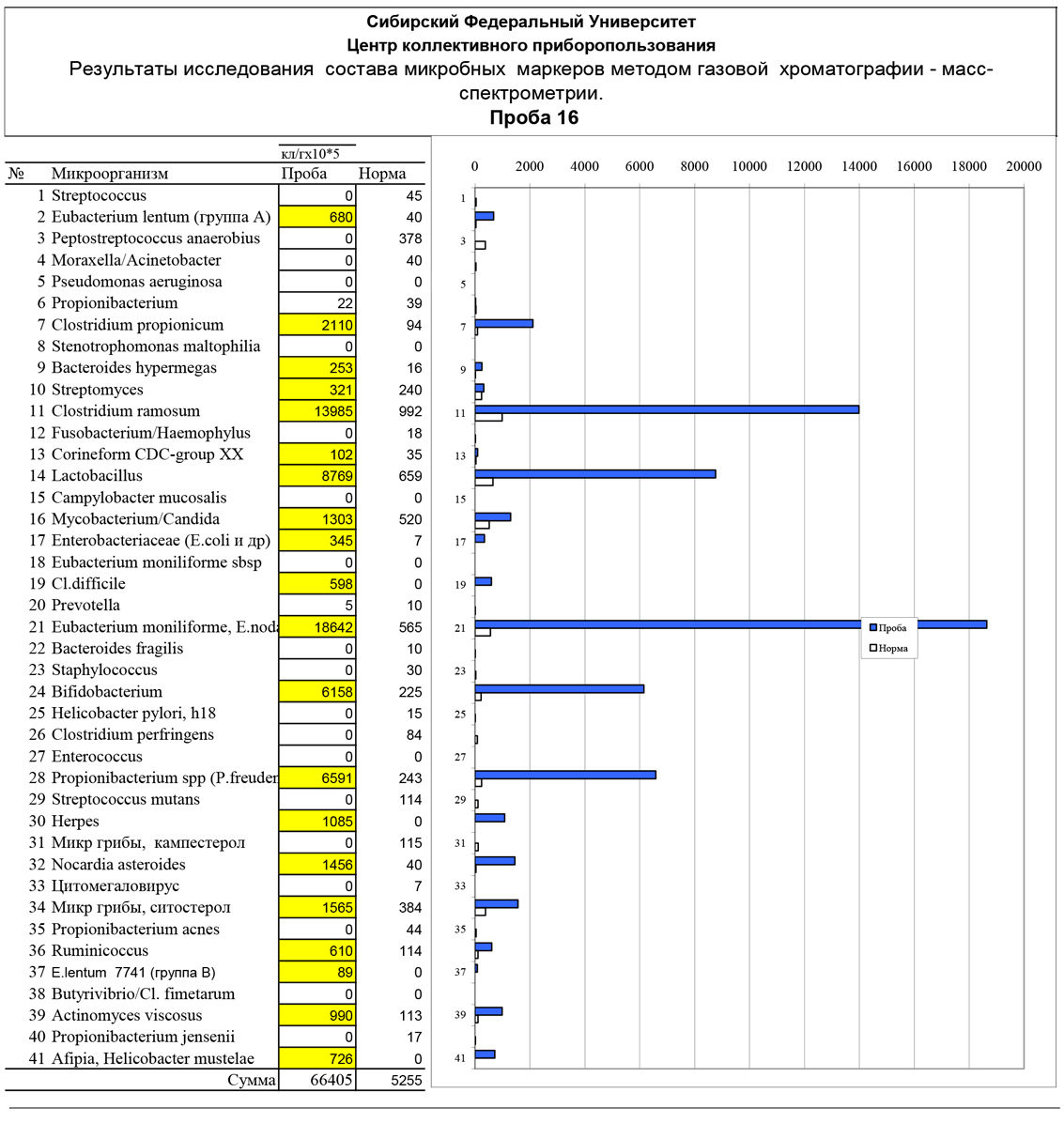
Ниже приведены гистограммы, на которых в виде столбиков отложена численность бактерий, колонизирующих нос и зев при ИМН, ангинах и тонзиллитах в сравнении с нормой и другими патологиями. Слева показана норма крови и зева (у здоровых людей). Далее:
Здоровый 1-10 – группа детей без респираторных заболеваний
ИМН-ангина – 1-19 – группа детей (n=19) с инфекционным мононуклеозом с ангинами
Нос-контроль 1-5 – здоровые дети
Нос-аденоидит 1-6 – мазок из носа больных с аденоидитом
Миндалина-аденоидит 1-8 – мазок с миндалин
Глотка-аденоидит 1-8 – мазок с задней стенки глотки
Группа данных в правой части гистограммы представляет численность тех же микроорганизмов в мокроте, миометрии матки, смыве трахеи и раневом отделяемом для сравнения. По оси ординат отложена расчетная численность микроорганизмов по их маркерам в клетках на грамм материала в мазке. Числа на оси надо домножить на коэффициент 105 степени. Например, число 30000 на следующей за текстом диаграмме соответствует 30000×105 клеток/г или 3×109 клеток/г.
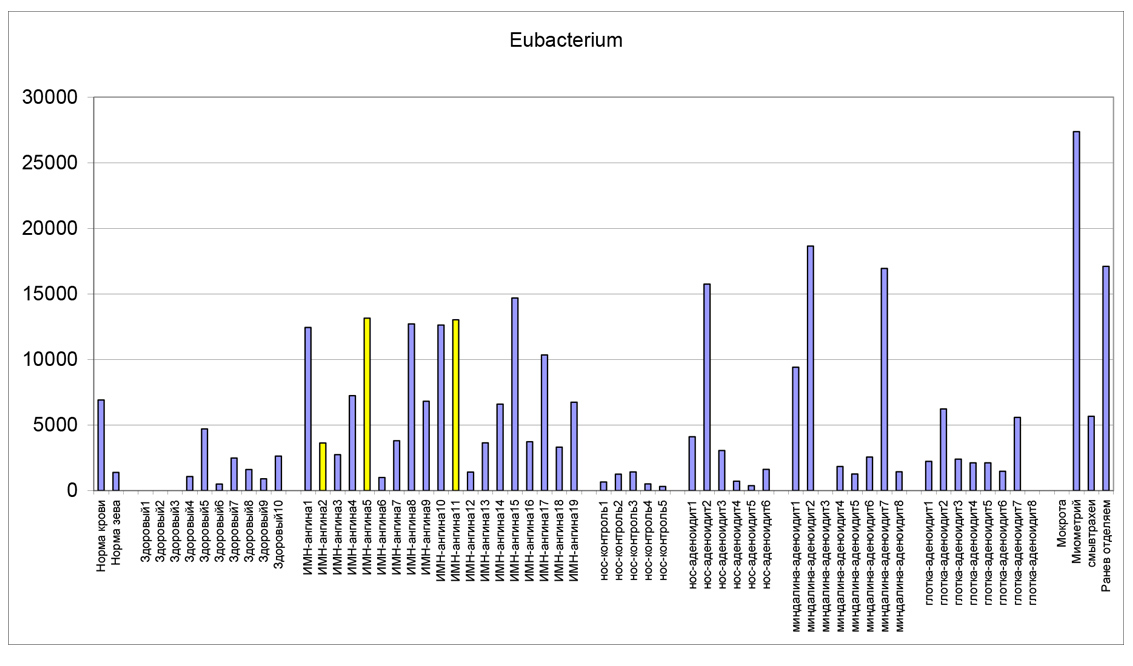
Как видно, нет системы в участии эубактерий в заболеваниях ЛОР-органов.
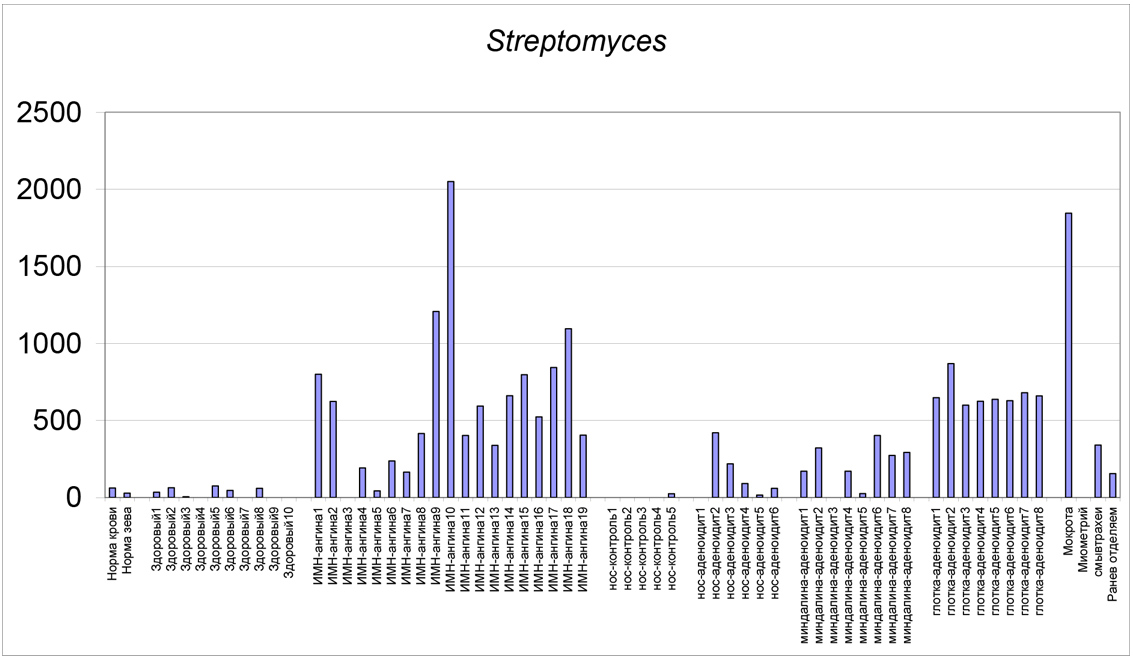
Вирус герпеса участвует гораздо активнее при ЛОР-инфекциях, по сравнению с другими патологиями (четыре столбика справа)

